Exercícios de Solubilidade Química
1) (UFBA) Sobre soluções, pode-se afirmar:
(01) O latão, mistura de cobre e zinco, é uma solução sólida.
(02) Soluções saturadas apresentam soluto em quantidade menor do que o limite estabelecido pelo
coeficiente de solubilidade.
(04) A variação da pressão altera a solubilidade dos gases nos líquidos.
(08) O etanol é separado do álcool hidratado por destilação simples.
(16) Dissolvendo-se 30 g de NaCl em água, de tal forma que o volume total seja 500 mL, a concentração da solução obtida é igual a 0,513 mol/L.
(32) Adicionando-se 0,30 L de água a 0,70 L de uma solução 2 mol/L de HCl, a concentração da solução resultante é igual a 1,4 mol/L.
(64) A solubilidade de qualquer substância química, em água, aumenta com o aumento da temperatura.
2) A principal característica de uma solução é:
a) ser sempre uma mistura homogênea.
b) possuir sempre um líquido com outra substância dissolvida.
c) ser um sistema com mais de uma fase.
d) ser homogênea ou heterogênea, dependendo das condições de pressão e temperatura.
e) ser uma substância pura em um único estado físico.
3) Assinale a alternativa que contém exemplos de soluções:
a) água de torneira, mar, granito.
b) granito, mistura de água e óleo, ar.
c) petróleo no mar, granito, água destilada.
d) água pura, gás nitrogênio, ouro puro.
e) ar, água de torneira, ouro 18 quilates.
4) (UFPR) Uma solução é uma mistura homogênea de duas ou mais substâncias, não importando seu estado físico. Quando algum dos componentes da solução encontra-se dissolvido além de seu limite de dissolução, diz-se que a solução está supersaturada em relação àquele componente. Uma garrafa de um refrigerante contém uma solução que geralmente é constituída por: água, sacarose, acidulante (o mais utilizado é o ácido fosfórico), um corante, um aromatizante (que pode funcionar também como corante) e dióxido de carbono dissolvido sob pressão.
Considerando as informações acima e o seu conhecimento sobre o assunto, é correto afirmar:
(01) No refrigerante, o componente mais abundante é o solvente, ou seja, a água.
(02) O refrigerante apresenta pH menor que 7.
(04) A agitação do refrigerante provoca a saída do componente que se encontra dissolvido além do seu limite de dissolução.
(08) Ao final do processo de evaporação do refrigerante não há resíduos sólidos.
(16) A elevação da temperatura geralmente provoca a diminuição da solubilidade dos solutos gasosos.
5) (FMU-FIAM-FAAM-SP) Os frascos contêm soluções saturadas de cloreto de sódio (sal de cozinha).

Diferentes soluções em exercícios sobre solubilidade e saturação
Podemos afirmar que:
a) a solução do frasco II é a mais concentrada que a solução do frasco I.
b) a solução do frasco I possui maior concentração de íons dissolvidos.
c) as soluções dos frascos I e II possuem igual concentração.
d) se adicionarmos cloreto de sódio à solução I, sua concentração aumentará.
e) se adicionarmos cloreto de sódio à solução II, sua concentração aumentará.
6) (UFRS) Quais são as soluções aquosas contendo uma única substância dissolvida que podem apresentar corpo de fundo dessa substância?
a) saturadas e supersaturadas.
b) somente as saturadas.
c) insaturadas diluídas.
d) somente as supersaturadas.
e) insaturadas concentradas.
a) saturadas e supersaturadas.
b) somente as saturadas.
c) insaturadas diluídas.
d) somente as supersaturadas.
e) insaturadas concentradas.
7) (PUC SP) A uma solução de cloreto de sódio foi adicionado um cristal desse sal e verificou-se que não se dissolveu, provocando, ainda, a formação de um precipitado. Pode-se inferir que a solução original era:
a) estável.
b) diluída.
c) saturada.
d) concentrada.
e) supersaturada.
a) estável.
b) diluída.
c) saturada.
d) concentrada.
e) supersaturada.
8) Relacione as duas colunas abaixo, classificando o tipo de solução que será obtido ao adicionar a 100 g de água as massas dos solutos apresentadas na coluna II em temperatura de 20ºC. (Consulte a tabela de solubilidades):
Coluna I: Coluna II:
a) insaturada I- 50 g de NaCl.
b) saturada II- 5,0 g de KCl.
c) supersaturada III- 33,0 g de açúcar.
d) saturada com corpo de chão IV- 0,15 g de hidróxido de cálcio.
V- 36 g de NaCl.
VI- 80 g de açúcar (a solução é aquecida até 100ºC e deixada esfriar até 20ºC)

Valores de coeficientes de solubilidade de diferentes substâncias em 100 g de água a 20ºC
9) A 42ºC, a solubilidade de certo sal é de 15 g para cada 100 g de água. Assinale a alternativa que indica corretamente a solução que será formada nessa temperatura se adicionarmos 30 g desse sal em 200 g de água e agitarmos convenientemente:
a) insaturada.
b) saturada.
c) supersaturada.
d) saturada com corpo de chão.
a) insaturada.
b) saturada.
c) supersaturada.
d) saturada com corpo de chão.
10) Ao acrescentar 652,5 g de nitrato de sódio (NaNO3) a 750 g de água a 20ºC, obtém-se uma solução saturada desse sal. Encontre a solubilidade do nitrato de sódio em 100 g de água nessa temperatura:
a) 65,25 g.
b) 87 g.
c) 100 g.
d) 1,0 g.
e) 57 g.
a) 65,25 g.
b) 87 g.
c) 100 g.
d) 1,0 g.
e) 57 g.
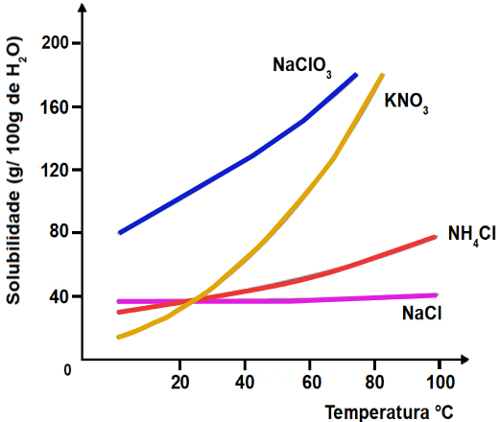
11) O gráfico abaixo indica as curvas de solubilidade de quatro diferentes sais:
Qual destes sais apresenta maior solubilidade a 40oC?
a) NaClO3
b) KNO3
c) NH4Cl
d) NaCl
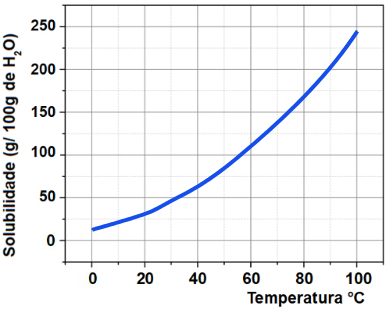
12) A curva de solubilidade da substância KNO3 dissolvida em 100 g de água em função da temperatura é mostrada abaixo.
Se tivermos 40g de água a 50o C, qual será a massa de KNO3 dissolvida?
a) 28 g
b) 56 g
c) 33,6 g
d) 45 g
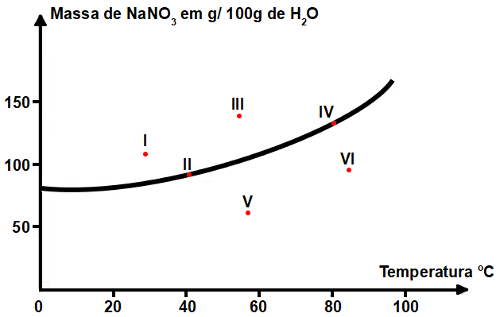
13) (UFMG) Seis soluções aquosas de nitrato de sódio (NaNO3), numeradas de I a VI, foram preparadas em diferentes temperaturas dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3 em função da temperatura. Os seis pontos correspondem aos sistemas preparados:
A partir da análise desse gráfico, é CORRETO afirmar que os dois sistemas em que há precipitado são:
a) I e II
b) I e III
c) IV e V
d) V e VI
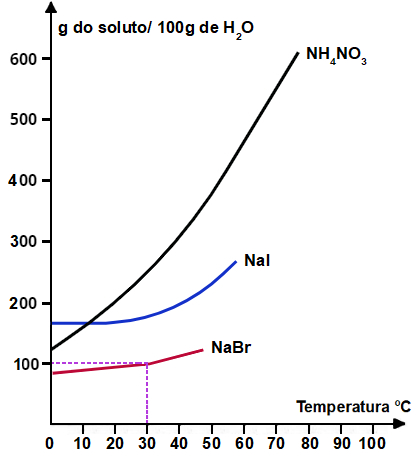
14) Observe o gráfico abaixo e analise as afirmações de I a IV.
I- Se acrescentamos 250 g de NH4NO3 a 50g de água a 60°C, obteremos uma solução saturada com corpo de chão.
II- A dissolução do NH4NO3 e do Nal em água ocorre com liberação e absorção de calor, respectivamente.
III- A 40°C, o Nal é mais solúvel que o NaBr e menos solúvel que o NH4NO3.
IV- Quando uma solução aquosa saturada de NH4NO3, inicialmente preparada a 60°C, for resfriada a 10°C, obteremos uma solução insaturada.
Está correto apenas o que se afirma em:
a) I e II
b) I e III
c) I e IV
d) II e III
e) III e IV
Comentários
Postar um comentário